12月2日,临床阶段眼科生物科技公司Cloudbreak Pharma Inc(即“拨康视云”)再次披露港交所主板上市申请材料。这是该公司第三次冲刺港股IPO,此前曾分别于2023年11月30日、2024年5月31日递交上市申请。
核心产品处于临床阶段
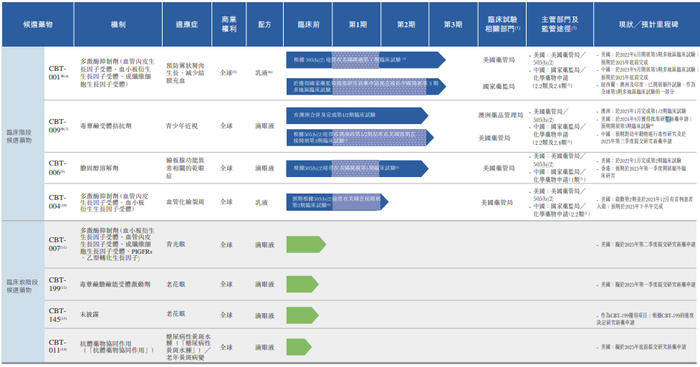
作为临床阶段眼科生物科技公司,拨康视云成立于2015年9月,公司自主研发管线包括两款核心产品(CBT-001及CBT-009),覆盖眼睛前部和后部的主要疾病。公司共有四款处于临床阶段的候选药物及四款处于临床前阶段的候选药物。
目前,该公司董事会主席、执行董事、首席执行官兼本集团联合创始人Ni Jinsong及其配偶Bing Leng于合共172,150,042股普通股中拥有权益,占公司全部已发行股本约22.18%。成立以来,拨康视云共完成4轮融资动作,合计获得投资额1.44亿美元。
具体看来,拨康视云旗下核心产品CBT-001适用于治疗翼状胬肉(一种良性增生性眼表疾病),分别于2022年6月及2023年9月在美国及中国启动第3期多地区临床试验(多地区临床试验)。一旦CBT-001获得批准,有望成为全球首款用来治疗翼状胬肉的药物。

该公司另一核心产品CBT-009是唯一采用非水性制剂的临床阶段候选药物,用于治疗青少年近视(5至19岁儿童及青少年近视),于2023年1月完成第1/2期临床试验,并于2024年7月向美国食品及药物管理局提交研究新药申请。
拨康视云还拥有其他两个临床阶段候选药物CBT-006(治疗睑板腺功能异常相关的干眼症)及CBT-004(治疗血管化睑裂斑),及四款临床前阶段候选药物CBT-007(用于提高青光眼滤过手术的成功率)、CBT-199及CBT-145(分别为适用于治疗老花眼的新制剂及新化学实体)及CBT-011(一种适用于治疗糖尿病性黄斑水肿)。
不过,该公司称,其最终可能无法成功开发和推销任何候选药物。比如,CBT-001的市场潜力可能有限,市场机会可能比预期小,乃由于不利因素(包括但不限于)对目标患者群体的估计不准确,患者对某部分药物标签外用药的接受度更高,以及/或难以接触医学界及患者。
根据弗若斯特沙利文报告,翼状胬肉药物的全球市场规模预期将于2028年及2033年分别达到5.37亿美元及31.1亿美元,复合年增长率为42.1%;截至最后实际可行日期,全球有四款适用于翼状胬肉及减少结膜充血的临床阶段候选药物,其中两款处于第2期临床试验阶段及其中一款处于第3期临床试验阶段,即CBT-001。
就产品定价情况,拨康视云预计CBT-001在中国的定价约为6000元,与Eylea玻璃体内注射液(40毫克/毫升)在中国的上市价格每0.05毫升6000元相当。目前,全球并无获批的药物用来治疗翼状胬肉,翼状胬肉的现有治疗选择是手术切除,在美国,每次手术的费用介乎收费标准价格5000美元至10000美元,不包括术后随访,而在中国则约为3000元。
同时,该公司预计CBT-009的保质期长达两年或更长,且舒适度更高,可直接向药房和眼科医生办公室分销,售价为75美元至100美元(平均每月批发价),目前计划商业化后CBT-009的定价比沈阳兴齐的硫酸阿托品(每位患者每年费用为3625元)高约50%,且不纳入国家医保目录,乃由于CBT-009可能具有更好的耐受性及更长的保质期。
筹备核心产品商业化,建立苏州试生产设施
另据招股书,拨康视云已开发两个专有技术平台,即多激酶抑制剂(MKI)及抗体药物协同作用(ADS)平台,分别用于开发治疗眼睛前部及后部疾病的候选药物。MKI平台及ADS平台各自分别以开发小分子药物以及抗体-小分子药物共轭物为目标。
该公司计划根据临床开发进展及商业化需要,在苏州建立一个符合全球相关监管机构规定的各种质量标准的大型商业生产设施,为候选药物的预期商业化做好准备。据悉,拨康视云在技术及工业发展专门指定地区苏州高新技术产业开发区建立试生产设施。试生产设施总建筑面积为1226.43平方米,将能支持公司全球临床试验及未来产品的全球商业化。
拨康视云表示,假设公司获得美国及中国的监管批准,则短期内其商业化准备工作将专注于公司最成熟的核心产品CBT-001。在美国,公司计划与主要研究者保持紧密关系;一旦获批,公司计划在美国透过直接面向消费者活动及眼部护理专业人员教育活动实现CBT-001商业化,并寻求政府及私人保险机构作为第三方偿付CBT-001的成本;公司亦可能就CBT-001在美国的生产及商业化寻求与领先医药公司的合作。在大中华区,该公司在2020年4月与远大医药订立商业化许可安排,并于2024年8月与参天订立一项许可协议,以开发、生产及商业化任何含有尼达尼布作为单一或其中一种活性药物成分。
该公司还透露,一旦CBT-009的第3期临床试验开始,公司计划进行类似市场教育活动,以筹备CBT-009商业化。一旦获得批准,公司计划通过与关键意见领袖及专业协会密切合作,通过直接面向消费者的活动及眼部护理专业人员教育活动,在美国及中国将CBT009商业化。该公司亦将逐步建立及扩大自身的销售及营销团队,以迎接未来产品的上市,这些动作将与候选药物管线的临床试验开发计划进展一致。
不过,拨康视云表示,迄今,公司的业务主要集中在筹集资金及开发候选药物,包括进行临床前研究及进行临床试验。公司目前在建立销售及营销团队、进行全面的市场分析、获得许可证及批准或管理候选药物的分销商及销售人员方面并无经验。“即使候选药物获得在美国或中国上市的监管批准,我们仍将面临重大商业化风险。”
拨康视云进一步指出,公司于可预见未来能否取得成功很大程度上取决于候选药物的临床试验能否成功完成、取得监管批准及进行商业化。候选药物的研发涉及漫长而昂贵的过程,且不能保证结果;候选药物受到广泛监管,且公司无法向阁下保证候选药物将会获得监管批准。该公司还表示,公司从产品中产生大量收益或成功将任何候选药物商业化的能力部分亦将取决于政府卫生管理部门对该等药物及相关治疗的报销程度。
成立至今未盈利,近三年半累亏2.84亿美元
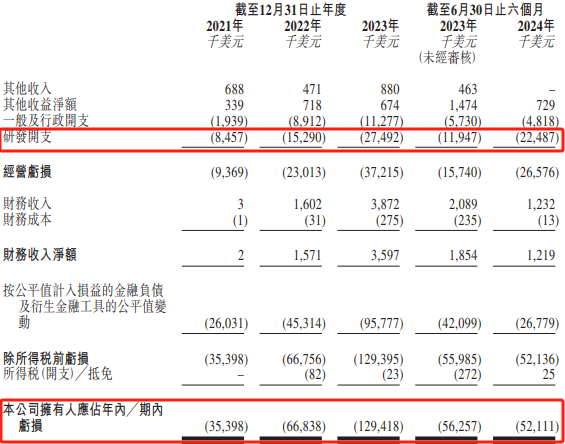
作为一家尚未录得收益的生物科技公司,拨康视云并无从正开发的候选药物中产生任何收益,自成立以来尚未获利且每年均录得经营亏损,于整个往绩记录期产生净亏损。财务数据显示,2021年至2023年及2024年前6月,该公司拥有人应占年/期内亏损分别是3539.8万美元、6683.8万美元、1.29亿美元及5211.1万美元。
拨康视云称,“预期于可见未来将继续产生亏损,原因为我们继续扩大候选药物开发、就候选药物寻求监管批准,以及因预期日后候选药物商业化而继续加强商业化工作及建立销售团队”。
于往绩记录期,拨康视云几乎所有亏损均来自一般及行政开支、研发开支及按公平值计入损益的金融负债以及衍生金融工具公平值变动。其中,2021年至2023及2024年前6月,拨康视云的研发开支分别为845.7万美元、1529万美元、2749.2万美元及2248.7万美元。
同期,该公司的核心产品CBT-001及CBT-009的临床研究开支分别为110万美元、760万美元、890万美元及1260万美元,分别占2021年、2022年及2023年及截至2024年6月30日止六个月研发开支的12.4%、49.4%、32.3%及56.0%,以及分别占2021年、2022年及2023年及截至2024年6月30日止六个月营运成本总额10.1%、31.2%、22.9%及48.1%。
拨康视云于整个往绩记录期的经营活动的现金流量为负数。自成立以来,该公司的营运已消耗大量现金。该公司称,其可能需要大量额外资金用于药物开发计划及商业化工作,而该等资金可能无法以可接受条款获得或根本无法获得;“尽管我们相信我们有充足的营运资金为当前业务提供资金,但预计我们的经营活动将于可见未来继续产生现金流出净额”。2021年至2023及2024年前6月,该公司的经营活动分别录得负现金流量623.1万美元、2005万美元、2250.6万美元及2001.9万美元。
另据招股书,2021年至2023年及2024年前6月,拨康视云负债总额分别是1.88亿美元、2.27亿美元、3.28亿美元及3.55亿美元,负债净额分别为7360万美元、1.45亿美元、2.63亿美元及3.1亿美元;对应年末的现金及现金等价物分别是8060.4万美元、1591.7万美元、5265.4万美元及4099.7万美元。
拨康视云表示,公司寻求改善流动资金及流动负债净额,并透过推动营运现金流量及改善流动负债净额状况确保未来营运资金充足。“随着我们继续加强研发能力,加速候选药物的临床开发,提高成本效率,并为候选药物量身定制多元化的商业化战略,目标为未来实现正经营现金流量。”
截至2024年6月30日,拨康视云有现金及现金等价物4099.7万美元。假设未来平均现金消耗率为截至2024年6月30日止六个月水平的1.3倍,该公司估计截至2024年6月30日的现金及现金等价物将能够维持财务可行性约10个月,或倘亦计及此次募资估计所得款项净额则约为31个月。
另需注意的是,拨康视云曾遭遇电信诈骗事件。自2019年2月20日至2019年3月4日,该公司执行董事兼首席营运官Van Son DINH收到冒充NI Jinsong(其电邮账户因网络攻击而被黑客入侵)的多封电子邮件。Van Son DINH当时根据有关电邮指示行事。该网络攻击事件造成106.5万美元的损失。该公司收到与该事件有关的保险赔偿41万美元,弥补部分损失。据公司所知,尚未能捕获疑犯。
拨康视云解释称,网络攻击事件发生时,Cloudbreak USA处于营运早期阶段,尚未建立健全的内部控制系统;于该事件发生后,该公司已采取额外的安全措施及执行经加强的内部控制协议来防止未来的网络攻击,并保护其电子邮件系统。截至最后实际可行日期,该公司再无遭遇其他网络攻击。



